Zakład Naukowy – Centrum Radiobiologii i Dozymetrii Biologicznej
Pracownia Dozymetrii Biologicznej
Instytut Chemii i Techniki Jądrowej
ul. Dorodna 16
03-195 Warszawa, Polska
Telefon: (+4822) 5041220, 5041000
Faks: (+4822) 8111917, 8111532
Kierownik Pracowni Dozymetrii Biologicznej – dr Sylwester Sommer
(tel. (+4822) 5041228, tel. kom 508536773, e-mail: s.sommer@ichtj.waw.pl lub silver.sommer@poczta.fm )
Zastępca Kierownika Pracowni Dozymetrii Biologicznej ds. technicznych – mgr inż. Iwona Buraczewska
(tel. (+4822) 5041226, e-mail: i.buraczewska@ichtj.waw.pl )

Zmotoryzowany mikroskop fluorescencyjny Zeiss ImagerZ2 z systemem automatycznego wyszukiwania metafaz (Metafer), automatycznej analizy: komet, automatycznej analizy częstości mikrojąder, liczby ognisk histonu gamma γH2AX, częstości translokacji metodą FISH
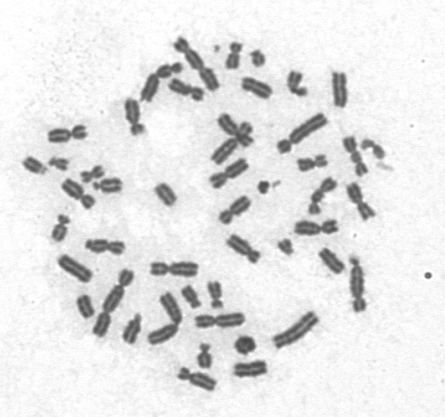
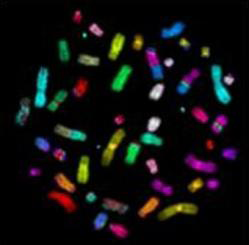
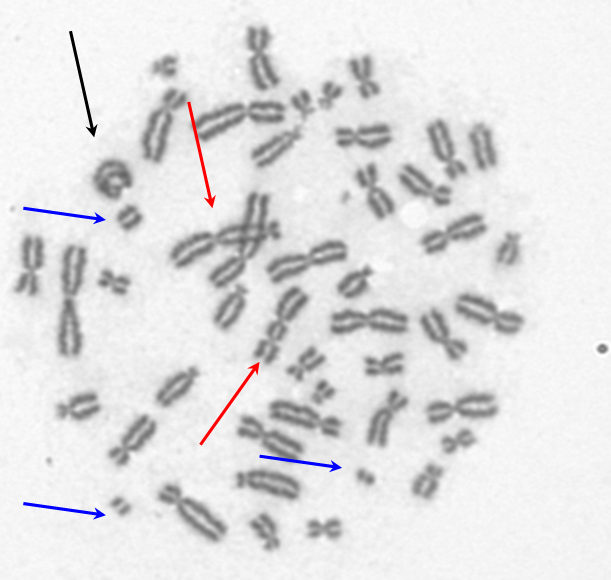
Limfocyt krwi obwodowej w trakcie mitozy, napromieniony 5 Gy promieniowania X. Widoczne liczne aberracje: w ramkach 6 chromosomów dicentrycznych, oprócz tego liczne fragmenty acentryczne i pierścień centryczny
W Pracowni Dozymetrii Biologicznej oznaczamy dawkę pochłoniętą promieniowania jonizującego w organizmie ludzkim przy pomocy różnych metod dozymetrii biologicznej:
- analizy częstości chromosomów dicentrycznych
- analizy mikrojąder (ręcznej i semi-automatycznej)
- analizy translokacji przy pomocy techniki FISH
- analizy częstości ognisk histonu gamma-H2AX
- analizy częstości dodatkowych fragmentów acentrycznych przy pomocy przedwczesnej kondensacji chromatyny PCC
-
Ręczna i semi-automatyczna analiza mikrojąder – pozwala oszacować dawkę pochłonięta w zakresie 0,3 – 3 Gy szybko i precyzyjnie. Popromienne mikrojądra są to fragmenty chromosomów, które nie zostały włączone do jąder komórkowych w czasie podziału i są widoczne jako struktury morfologicznie przypominające jądro w cytoplazmie. Liczba mikrojąder jest proporcjonalne do dawki promieniowania. Test wygląda podobnie do testu chromosomów dicentrycznych – pobieramy niewielką próbkę krwi żylnej. Limfocyty są stymulowane do podziału, dodawana jest cytochalazyna b w celu zablokowania cytokinezy i krew jest hodowana przez 72 godziny. Następnie komórki są utrwalane, nanoszone na szkiełka mikroskopowe, barwione i analizowane ręcznie lub semi-automatycznie (metoda 5- krotnie szybsza a dająca porównywalne wyniki). Dawka odczytywana jest z krzywej kalibracyjnej dla kobaltu 60 lub promieniowania X (200 kV, 4,5 mA o energii 200 keV) i wyznacza się 95 % przedział ufności dla niej.
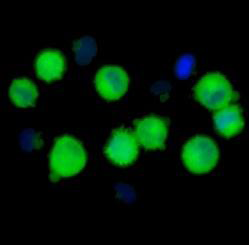
Limfocyt dwujądrzasty z trzema indukowanymi promieniowaniem mikrojądrami 
Galeria limfocytów dwujądrzastych z widocznymi, indukowanymi promieniowaniem mikrojądrami, utworzona w programie Metasytems -
Analiza translokacji przy pomocy techniki FISH (Fluorescence in situ hybridization) – pozwala oszacować dawkę przy pomocy analizy translokacji. Metoda jest droższa niż analiza dicentryków i używa się jej zasadniczo w dozymetrii retrospektywnej, kiedy od napromienienia do analizy minęło dużo czasu: kilka miesięcy czy lat. W takiej sytuacji częstość chromosomów dicentrycznych spada, natomiast częstość translokacji pozostaje na względnie stałym poziomie.
Analiza translokacji odbywa się na preparatach mikroskopowych uzyskanych podobnie jak przy teście chromosomów dicentrycznych. Utrwalone na szkiełkach mikroskopowych chromosomy hybrydyzowane są ze znakowanymi fluorescencyjnie sondami DNA, dzięki czemu możliwa jest analiza translokacji. W naszym laboratorium barwimy 3 pary chromosomów: chromosomy 1, 2 i 3.
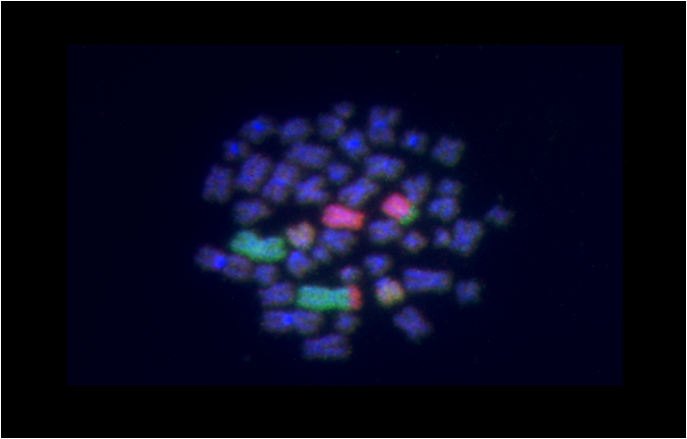
Trzy pary chromosomów wybarwione techniką FISH. Widoczna translokacja -
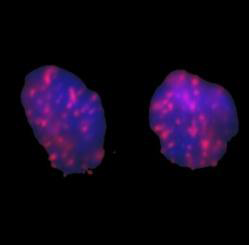
Analiza częstości ognisk histonu gamma-H2AX – pozwala oszacować dawkę promieniowania w zakresie 0,1 – 5,0 Gy przy pomocy oceny częstości ognisk histonu gamma-H2AX. Metoda polega na immunohistochemicznym barwieniu ognisk ufosforylowanej wersji histonu H2AX w utrwalonych na szkiełkach mikoskopowych jądrach limfocytów ludzkich. Fosforylacja histonu H2AX zachodzi po uszkodzeniu DNA i jest związana z naprawą podwójnoniciowych pęknięć DNA, które są charakterystyczne dla promieniowania jonizującego.
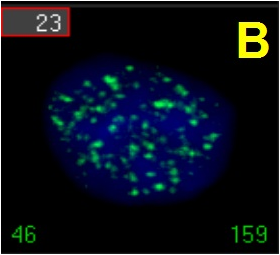
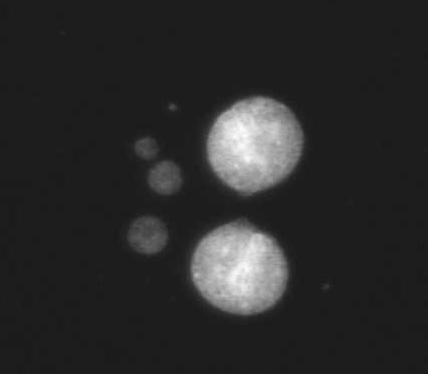
Jądro ludzkiego limfocytu po działaniu promieniowania jonizującego. Widoczne liczne ogniska histonu gamma-H2AX wybarwione immunohistochemicznie -
Analiza częstości dodatkowych fragmentów acentrycznych przy pomocy przedwczesnej kondensacji chromatyny PCC – jest to zbiór metod, gdzie zmiany wywołane promieniowaniem obserwuje się w sztucznie skondensowanym materiale genetycznym w komórkach nie będących w trakcie mitozy. Komórki napromienione wysoką dawką mają trudności aby przejść przez cykl komórkowy i znaleźć się w mitozie, a jest to konieczne jeżeli chcemy zastosować do biodozymetrii metodę analizy częstości dicentryków, analizy mikrojąder (w tym przypadku komórki muszą przejść cały cykl podziałowy i stworzyć jądra potomne) czy analizę translokacji. Metoda przedwczesnej kondensacji chromatyny w zależności od wersji wymaga, aby komórki weszły w fazę G1 albo G2 cyklu komórkowego i jest stosowana przy dużych dawkach promieniowania rzędu kilku Gy, gdy komórki raczej nie dojdą do mitozy.
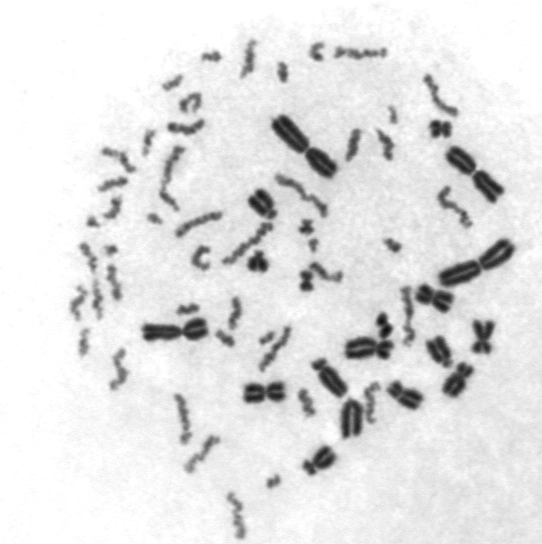
Przedwczesna kondensacja chromosomów ludzkich (cienkie, lżej wybarwione chromosomy składające się z jednej chromatydy) przy pomocy fuzji z mitotycznymi komórkami chomiczymi (mocniej wybarwione chromosomy, składające się z dwóch chromatyd). Liczba ludzkich chromosomów zwiększa się proporcjonalnie do dawki promieniowania
-
Dodatkowo prowadzimy badania genotoskyczności zgodnie z normami OECD 473 i 487 przy pomocy analizy aberracji chromosomowych lub mikrojąder na liniach komórkowych.
Badanie akredytowane wykonywane przez Pracownię Dozymetrii Biologicznej – analiza częstości chromosomów dicentrycznych
 AB 1577
Oznaczanie dawki pochłoniętej promieniowania gamma 60Co i promieniowania X o energii 200 keV na podstawie oceny częstości występowania chromosomów dicentrycznych w ludzkich limfocytach krwi obwodowej. Zakres metody: 0,2 Gy - 4 Gy. Metoda cytogenetycznej dozymetrii biologicznej.
AB 1577
Oznaczanie dawki pochłoniętej promieniowania gamma 60Co i promieniowania X o energii 200 keV na podstawie oceny częstości występowania chromosomów dicentrycznych w ludzkich limfocytach krwi obwodowej. Zakres metody: 0,2 Gy - 4 Gy. Metoda cytogenetycznej dozymetrii biologicznej.
Aktualny zakres akredytacji oraz dodatkowe informacje o Pracowni Dozymetrii Biologicznej znajdują się na stronach Polskiego Centrum Akredytacji:
https://www.pca.gov.pl/akredytowane-podmioty/akredytacje-aktywne/laboratoria-badawcze/AB%201577,podmiot.html
Zlecenie na wykonanie badań
Koszt badania próbki krwi wynosi: 1500 zł + 23 % VAT
Opis metody (nie objęty akredytacją):
Test częstości chromosomów dicentrycznych w limfocytach krwi obwodowej pozwala ocenić dawkę pochłoniętą promieniowania u danej osoby. Limfocyty w pobranej próbce krwi są stymulowane do podziału, hodowane przez 24 godziny, a następnie utrwalone naniesione na szkiełka mikroskopowe. Częstość dicentryków w nienapromienionych, kontrolnych próbkach krwi mieści się w przedziale 1 dicentryk na 1000 – 2000 komórek będących w pierwszej metafazie po podziale. Dicentryki są aberracjami indukowanymi specyficznie przez promieniowanie jonizujące oraz przez niektóre leki cytostatyczne działające podobnie do promieniowania (radiomimetyki).
Dawkę pochłoniętą na całe ciało (otrzymaną w krótkim czasie – acute dose) szacuje się korzystając z krzywej kalibracyjnej dla kobaltu 60 lub promieniowania X (200 kV, 4,5 mA o energii 200 keV) i wyznacza się 95 % przedział ufności dla niej. Używając standardowych metod statystycznych można przeliczyć dawkę otrzymaną w krótkim czasie na dawką chroniczną, jeżeli była otrzymana w czasie kilkudziesięciu godzin oraz oszacować czy mamy do czynienia z dawką podaną na całe ciało, czy tylko na jego część. Wszystkie przeprowadzone obliczenia oparte są na metodach zawartych w normie ISO 19238:2014.
Badania nie akredytowane:
Badanie genotoksyczności związków chemicznych i leków:
W naszej pracowni możemy badać genotoksyczność związków chemicznych i leków zgodnie z nomami OECD 473: GUIDELINE FOR THE TESTING OF CHEMICALS, In Vitro Mammalian Chromosome Aberration Test i OECD/OCDE 487: GUIDELINE FOR THE TESTING OF CHEMICALS, In vitro mammalian cell micronucleus test przy pomocy analizy aberracji chromosomowych lub analizy mikrojąder na komórkach CHO K1.
Oferta wykorzystania zmotoryzowanego mikroskopu Zeiss Imager Z2 2008
Pracownia Dozymetrii Biologicznej dysponuje zmotoryzowanym mikroskopem fluorescencyjnym Zeiss połączonym z systemem automatycznego wyszukiwania metafaz (Metafer – przydatne przy analizie chromosomów dicentrycznych i translokacji), automatycznej analizy: komet, automatycznej analizy częstości mikrojąder, oraz automatycznej analizy liczby ognisk histonu gamma-H2AX. Oferujemy współpracę przy szybkiej analizie materiału biologicznego używając wcześniej wymienionych technik. Współpraca może być bez kosztowa i polegać na opracowaniu wspólnych publikacji.


Współpraca krajowa i zagraniczna
Pracownia Dozymetrii Biologicznej współpracuje ściśle z Pracownią Dawek Indywidualnych i Środowiskowych Centralnego Laboratorium Ochrony Radiologicznej w Warszawie – zarówno przy konstrukcji krzywych kalibracyjnych, rekonstrukcji dawek jak i przy porównaniach miedzylaboratoryjnych.
Pracownia Dozymetrii Biologicznej jest partnerem Europejskiej Sieci Laboratoriów Dozymetrii Biologicznej i Retrospektywnej Dozymetrii Fizycznej RENEB. Dozymetria biologiczna w swojej klasycznej wersji jest zbyt pracochłonna aby zagwarantować szacowanie dawki w razie zdarzenia radiacyjnego na dużą skalę. W takim wypadku sieć RENEB pozwala dzielić się materiałem do analizy, co zapewnie szybsze uzyskanie oceny dawek. Procedury związane w przesyłaniem próbek są opracowane i przetestowane, metody dozymetrii są ujednolicone i zapewniona jest kontrola jakości. W ramach RENEBU odbywają się również porównania międzylaboratoryjne.